— Что это значит? Что в костном мозге девочки клетки крови, в том числе иммунные, зарождаются уже злокачественными, — рассказывает Metro Дмитрий Жданов, молекулярный биолог, доктор биологических наук, заведующий лабораторией медицинской биотехнологии ИБМХ имени В. Н. Ореховича. — Лейкоз сейчас лечат так: на первом этапе убивают костный мозг радиацией, то есть пациенты проходят лучевую терапию, чтобы уничтожить полностью все клетки патологического костного мозга. Вторым этапом производят трансплантацию костного мозга от здорового донора (чаще всего от ближайших родственников), заменяя убитую ткань тканью от донора костного мозга, в котором развиваются здоровые клетки крови. Эти способы, увы, помогают не всегда и влекут за собой большое количество осложнений. Кроме того, есть риск, что те опухолевые клетки, которые уже покинули костный мозг до процедуры трансплантации, после неё вернутся, болезнь возобновится. Поэтому учёные во всём мире работают над тем, как сделать лечение максимально безопасным и эффективным.
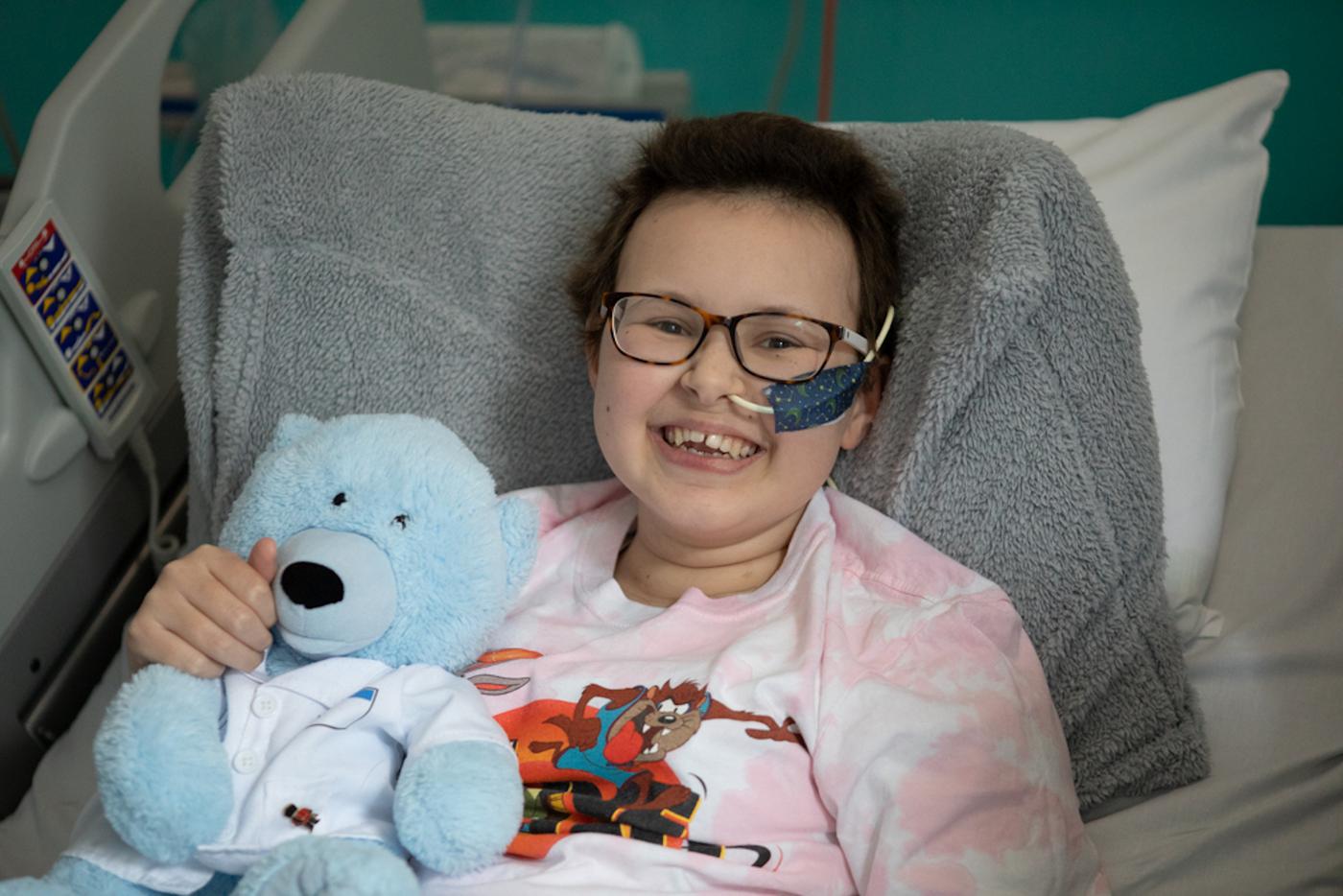
Алиссу лечили всеми известными способами, но безуспешно. Агрессивная форма рака не хотела отпускать девочку. И тогда остался единственный вариант: применить новый метод лечения, основанный на генетическом редактировании T-лимфоцитов. Алисса стала первым пациентом, получившим клеточную терапию в детской больнице Great Ormond Street (GOSH) в Лондоне, спустя всего 6 лет после создания метода в 2015 году.

То, что удалось сделать врачам, ещё несколько лет назад казалось маловероятным, а сегодня стало возможным благодаря большим достижениям в области генной инженерии.
— В нашей ДНК есть четыре вида азотистых оснований: аденин (А), цитозин (С), гуанин (G) и тимин (Т) — они являются строительными блоками нашего генетического кода. Подобно тому как буквы в алфавите составляют слова, несущие смысл, миллиарды оснований в нашем ДНК составляют инструкцию по эксплуатации тела, — рассказывает Дмитрий Жданов. — Редактирование этих блоков позволяет учёным приблизиться к определённой части генетического кода, а затем изменить молекулярную структуру одного блока, преобразовав его в другой, и таким образом перепрограммировать генетические инструкции.
В организме постоянно образуются злокачественные клетки. Чаще всего они поражаются клетками иммунной системы — Т-лимфоцитами. Но если случается сбой и злокачественные клетки выживают и размножаются, тогда развивается опухолевый процесс. Дмитрий Жданов, молекулярный биолог
Большая команда врачей и учёных из детской больницы Great Ormond Street в Лондоне использовала этот инструмент для разработки нового типа T-клеток, способных выслеживать и убивать раковые T-клетки Алиссы.
— Эта технология называется CAR-T-cells (Chimeric Antigen Receptor of T-cells) — прогрессивный метод лечения злокачественных опухолей, — делится Дмитрий Жданов. Принцип нового метода таков: Т-клетки берут из костного мозга здорового донора. Эти клетки репрограммируются так, чтобы они убивали опухолевые клетки. Для этого в них создаётся химерный антигенный рецептор, который позволяет клеткам распознавать опухолевые клетки и их уничтожать.
— Почему он химерный? Потому что состоит из различных частей, молекул, участвующих в распознавании опухолевых клеток. Чтобы в T-клетки вставить этот рецептор, и нужна технология генетического редактирования, — добавляет Дмитрий Жданов. — Что сделали английские коллеги? Они взяли иммунные клетки здорового донора, удалили существующие рецепторы, чтобы клетки стали "универсальными". Дело в том, что иммунные клетки могут нападать друг на друга и уничтожать себя, поэтому вторым этапом учёные удалили из них рецептор CD-7 путём редактирования букв кода ДНК. Изменение определённых нуклеотидных оснований в гене CD-7 c цитозина на тимин создаёт некий "стоп-кодон". Он не позволяет клеточному механизму читать полные инструкции, и производство CD-7 прекращается. Сделали они это, чтобы обезопасить здоровую клетку и исключить случаи токсической активности клеток друг к другу. Третьим шагом они удалили рецептор CD-52. Это редактирование делает клетку невидимой для некоторых сильнодействующих препаратов, которые даются пациенту во время лечения. И четвёртым этапом было как раз добавление химерного антигенного рецептора (CAR), который распознаёт T-клеточный рецептор CD-7 в лейкемических T-клетках. Клетки вооружаются против CD-7, распознают T-клеточный лейкоз и уничтожают опухолевые клетки.

Врачи и учёные все эти процессы произвели внутри ДНК клетки здорового донора, затем размножили клетки искусственно в пробирке и ввели их Алиссе, которая прежде прошла курс терапии, чтобы уничтожить все опухолевые клетки крови.
— Если после генетического редактирования 100 клеток в 5% из них всё пройдёт благополучно, это большой успех. Эти отредактированные клетки из успешных 5% отбирают и размножают искусственно. То есть размножаются уже модифицированные клетки. После уже их вживляют пациенту, – дополняет Дмитрий.
После того как Алиссе вживили модифицированные Т-клетки, она была очень уязвима для инфекции, поскольку эти клетки атаковали как лейкемические Т-клетки, так и здоровые иммунные. Через месяц у девочки наступила ремиссия, и ей сделали вторую пересадку костного мозга здорового донора, чтобы восстановить иммунную систему. Алисса провела в больнице 16 недель и не могла общаться с братом, который ходил в школу. Боялись, что он принесёт ей какую-либо инфекцию. Врачи продолжали наблюдать Алиссу, были опасения, что после трёх месяцев обнаружатся какие-либо признаки лейкемии, но два последних исследования подтвердили полное отсутствие каких-либо проявлений болезни.
— Врачи сказали, что первые шесть месяцев будут самыми важными, — рассказывает Metro мама Алиссы Криона. — Алисса очень взрослая, хотя и выглядит как ребёнок. Очень сильная. Она уже мечтает вернуться в школу, кататься на велосипеде и заниматься простыми обычными делами. Уже очень скоро это будет возможно!
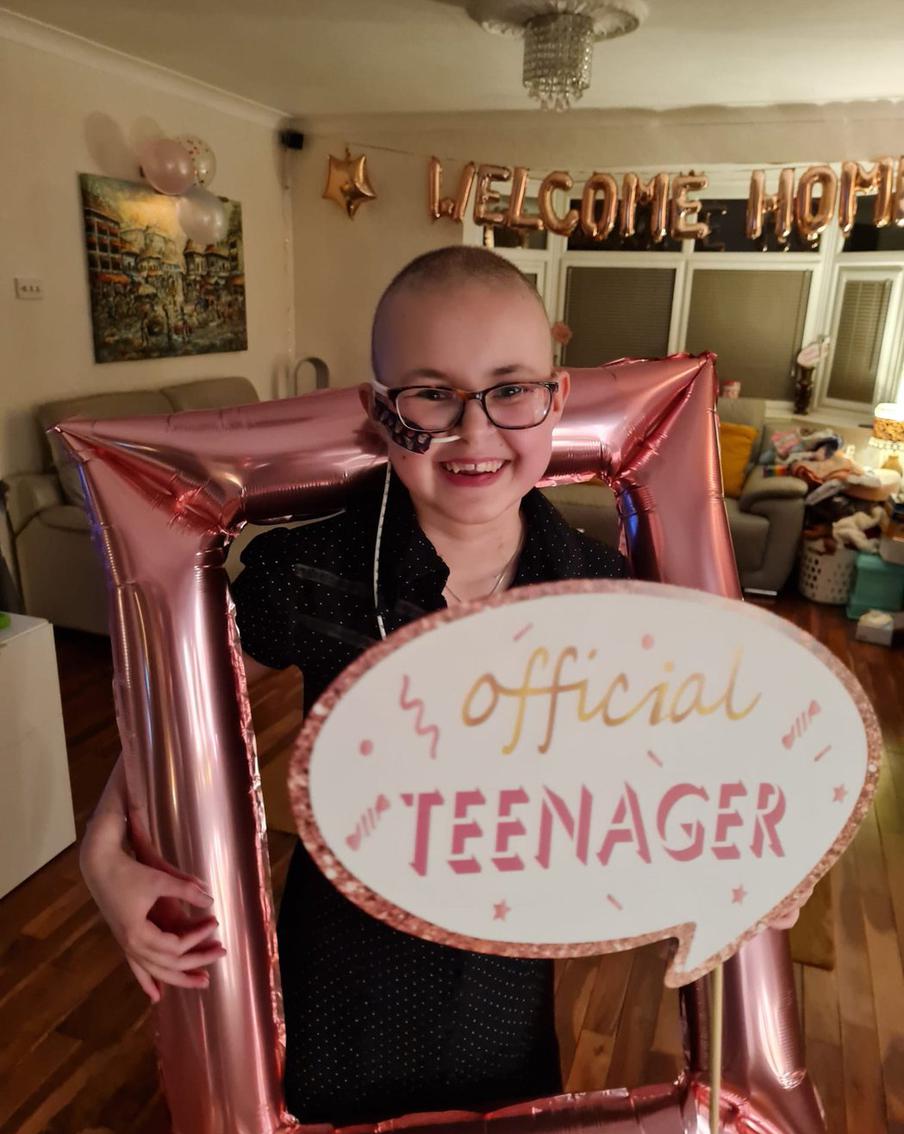
Алисса — первая из 10 человек, кто получил препарат в рамках клинических испытаний. Вазим Касим (Waseem Qasim), профессор клеточной и генной терапии из Калифорнийского университета, рассказал Metro, что на сегодняшний день это их самая сложная клеточная инженерия, которая открывает путь к другим новым методам лечения и лучшему будущему для больных детей.

— Клинические испытания этого лечения в настоящее время проходят 10 пациентов с Т-клеточным лейкозом, включая Алиссу. Все они исчерпали традиционные варианты лечения, — уточнил Вазим Касим. – Если испытания по пересадке костного мозга и терапии CAR-Т-клетками пройдут успешно, её можно будет предлагать детям на более ранних этапах лечения. В 2023 году мы будем работать и над другими типами лейкемии.
Технология CAR-T cells не нова. В нашей стране она сейчас также успешно развивается.
— Такой подход применим для заболеваний, против которых можно настроить иммунную систему, — дополняет Дмитрий Жданов. — Хочется верить, что испытания пройдут успешно, тогда это лечение смогут получать другие больные дети.